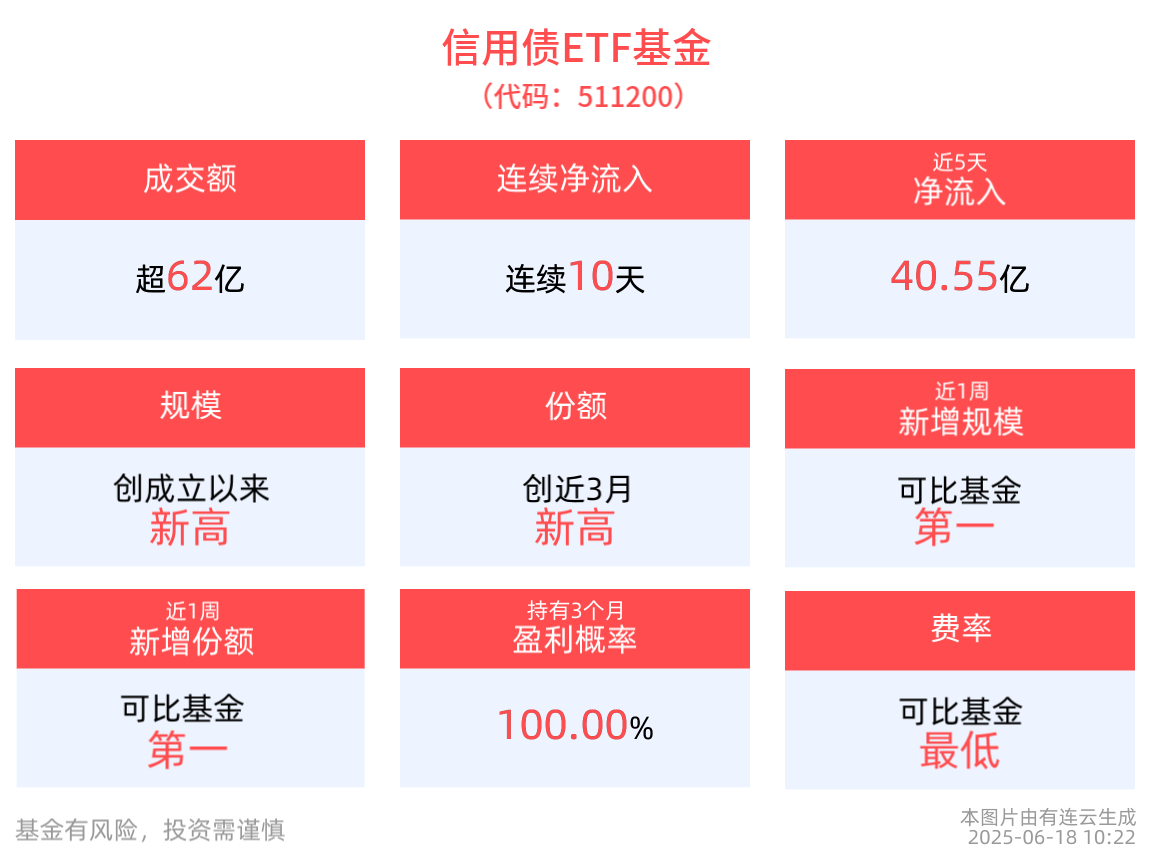
苏州泽璟生物制药股份有限公司在肿瘤药物研发领域实现了新的突破,其开发的ZG005注射剂与ZG006注射剂联合治疗方案,针对晚期小细胞肺癌以及神经内分泌癌,已成功获得国家药品监督管理局的认可。这一成果引发了业界的广泛关注。
获批喜讯
近期,苏州泽璟生物制药股份有限公司成功获得国家药品监督管理局的认可,并正式获得《药物临床试验批准通知书》。此通知书同意注射用ZG005与注射用ZG006的联合应用开展临床试验,试验目标为晚期小细胞肺癌或神经内分泌癌患者。尽管如此,公司亦明确表示大连市同乐中小企业商会,此次批准对公司的短期业绩影响有限。
ZG005 特点
ZG005是一种注射型药物,其主要成分是重组人源化抗PD-1/TIGIT双特异性抗体。该药物属于肿瘤免疫治疗领域的新型生物制品,其注册分类被划归为1类。ZG005在多种实体瘤治疗方面展现出应用潜力,同时也是首个针对该靶点开展临床研究的药物之一。截至目前,全球范围内尚无同类机制的药物获得上市批准。
ZG006 亮点
ZG006是一款具备三重特异性的抗体类药物,该产品由本企业及其子企业依托双/多特异性抗体研发技术平台成功开发。目前,该药物已取得美国食品药品监督管理局(FDA)及中国国家药品监督管理局(NMPA)的临床试验许可,同时,它还被美国FDA认定为孤儿药。ZG006作为全球首款针对DLL3靶点的三特异性抗体,展现出成为该领域最佳候选药物的巨大潜力。
临床前效果
临床前研究结果显示,ZG006在小鼠肿瘤模型实验中表现卓越。该药物在抑制肿瘤方面表现出显著效果,使得众多小鼠的肿瘤得以完全消退,从而证实了其卓越的肿瘤杀伤能力。这一成果为联合用药方案的临床试验带来了积极的前景。
年会进展
2025年,在ASCO年度会议上,泽璟生物披露了ZG005与ZG006两项药物的临床研究数据和最新进展。欲获取详细信息,请参阅泽璟生物于2025年6月3日通过上海证券交易所官方网站发布的公告。
风险提示
根据我国药品注册的相关法律和规定,药物在取得《药物临床试验批准通知书》后,需开展临床试验。同时,必须通过国家药品监督管理局的严格审查。只有通过这些程序,药物才能获准进入市场销售。鉴于医药产品研发周期长,涉及众多步骤,且易受多种不确定因素影响,存在无法获得上市销售许可证的风险。鉴于此,我们建议投资者在作出投资决策时需保持谨慎。

临床试验已批准该两种药物联合使用,这一举措为晚期小细胞肺癌和神经内分泌癌患者带来了新的治疗曙光。关于这两种药物在临床试验中联合使用的效果能否达到预期,各位有何高见?欢迎在评论区分享您的观点,并对本文进行点赞和转发。